
金属の諸性質は、それを構成している原子の種類によって定まります。このほかに同じ金属原子でも原子の並び方によって性質が著しく変わってきたりもします。金属材料の諸性質を原子レベルから理解することも技術者にとって必要なことです。
自然界に存在するすべての物質は、周期表に示される水素(H)からウラン(U)までの92種類の元素の組み合わせによって構成されています。これらの物質の中で、金属がいわゆる金属的性質を示すおもな原因は、
第1に、金属はすべて結晶であること、言い替えると、金属はそれを構成するすべての原子が規則正しい配列をなしていること。
第2は、それらの結晶を構成している原子どうしの結合が金属特有の結合方法によっていることです。
金属の諸性質は、もちろんそれを構成している原子の種類によって定まりますが、このほかに同じ金属原子でも原子の並び方によって性質が著しく変わってきます。また、金属材料として最も基本的な性質である強さは、原子の規則正しい並び方から乱れによって大きく左右されます。したがって実用金属材料の諸性質を論じ、これに適切な熱処理や加工を加え、また時代の要求に基づく新しい金属材料の開発を行うためには、原子レベルの観点から考えなければならない場合が多くなってきました。
原子の構造や本性を述べるのは非常にむずかしい問題で、正確には量子力学に基づいて理解されうるものです。しかしごく概念的には、原子の構造としては正の電荷を帯びた原子核を中心として、その周囲に原子番号に相当する数だけの負の電荷を帯びた電子がそれぞれの軌道上を回っており、原子全体としては電気的に中性の状態のものと考えられています。
Sponsored Link
結合
金属が金属特有の性質を示す原因の1つとして、結晶であることがありますが、金属以外にも結晶をなすものは数多くあります。
金属特有の性質、たとえば電気や熱をよく伝えること、大きな塑性変形態を有すること、あるいは金属光沢を有することというような性質を示すもう1つの根本的な原因は、原子間の結合の仕方にあります。一般に原子どうしが結合する仕方を大別すると、
イオン結合・共有結合・金属結合・ファンデルワールス結合
があります。
多くの物質の中には、この中間状態や2つの結合方法を兼ねている場合もあり、金属でもAuやCuは純粋な金属結合をしていますが、SbやAsなどになると金属結合の形から共有結合の色彩が濃くなって、金属的特性が薄れていきます。
イオン結合 (ionic bond)
結合力の中で一番簡単に理解できるのは、原子どうしが電子をやりとりして正と負のイオンになったときに働く、両イオン間の静電気的な力によるイオン結合で、その代表的な例は食塩のNaClの結晶があります。
これは互いに結び付く原子が、正・負の電荷をもったNa+とCl–のように、はっきりした違いを示す場合であるので、異極結合ともいわれています。
このようなイオン結合では電子が両イオンの間に固定されるので金属のような電気伝導は可能ではないが、イオンの一方または両方が動くことによる結果として弱いイオン伝導が起こります。また外力を加えると金属の場合は伸びて変形しますが、イオン結合ではある原子面に沿ってへき開破壊を起こします。
共有結合 (covalent bond)
ダイヤモンドはC原子のみという同種類の原子間に力が働いて結合が起こります。
この場合の結合力はイオン結合の静電気的な力では理解できないもので、量子力学によってはじめて説明が可能になりますが、簡単にいえば次のようなことになります。
2つの原子のおのおのの一番外側にある電子が、この両原子のみに共通の電子軌道上を動いて互いに手を取り合って、その力で2つの原子を結び付けている状態のもの。この結合にあずかる電子は、もはやどちらの原子に属しているともいえず、2つの原子に共有された形になるので、この種の結合を共有結合といい、また異種結合に対して同種結合ともいいます。
共有結合の代表的な例はダイヤモンドで、強い方向性があるほかに、原子間の結合力が強いので硬さが大きく、また結晶内全体を動き回る電子がないので電気の不導体であり、光に対しては透明になります。
金属結合 (metallic bond)
金属原子の結合も同種類の原子間に働く力によるもので、一番外側にある電子が各原子から飛び出して、それらが互いに手を取り合って原子を結び付けている点は一種の共有結合といえます。
ただ共有結合と異なる点は、飛び出した電子が特定の2原子間だけに共有されるのではなく、その金属結晶を構成している原子全体に共有されている点です。
すなわち、金属の結合では最も外側の電子を遊離した金属原子がすべての原子全体を取り囲む多数の電子の厚い雲の中に埋まっていて、その遊離した電子雲と残りの金属イオン群との間の相互作用によって各原子が互いに結び付けられています。
したがって、電子雲の中では電子が結晶全体の中を自由に移動できるので、電気および熱をよく伝える。また金属原子はすべて等価であって、外から応力を加えるとある場所で結合が壊れて別の位置にすべっても容易にそこで再び結合できるので、金属の特性である塑性変形が可能であり、可視光線が金属に当たると電子雲で散乱されて金属光沢を示します。
ファン・デル・ワールス結合 (van der Waals bond)
NeやArのような原子は、ほかの原子と化合する力をほとんどもっていません。しかしこのような原子間でも、電気的に中性な原子どうしが接近すると、それらの原子内部で各瞬間の状態で考えると、正と負の電荷の分布に偏りが生じて分極を起こし、その結果形成された電気双極子間に弱い電気的な引力が起こります。
これがファン・デル・ワールス力で、分子の大きさが小さい場合には、ごく低い温度においてのみ原子の熱振動に打ち勝って原子どうしを結合することができます。したがって、この力で結合しているものは非常に低温度で融解します。たとえばArの固体は-190℃で融解し、-186℃で気体になってしまいます。
Sponsored Link
補足説明
原子とは、
物質を構成する最小の粒子。
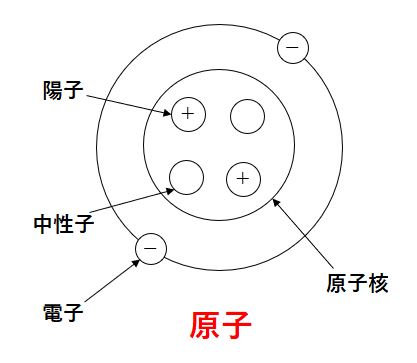
すべての物質は原子が集まってできている、と言える。
電子:-の電気を帯びた粒。
原子核:陽子(+の電気を帯びた粒)と中性子(+でも-でもない粒)からなる。
陽子と電子の数は等しい。これを「電気的に中性」という。
イオンとは、
原子が電子を得たり、失ったりして電気を帯びたものをイオンという。
原子が電子を失って+に帯電したものを陽イオン(プラスイオン)
原子が電子を受け取って−に帯電したものを陰イオン(マイナスイオン)
金属の結晶構造と特性
金属は原子がそれぞれの金属に特有の規則正しい配列をしており、その配列の仕方によってその諸性質は著しく影響されます。金属の種類は非常に多いですが、その大部分が3つの基本的な結晶構造(体心立方格子・面心立方格子・稠密六方格子)のうちのどれか1つに属することは、X線回析そのほかの研究の結果から照明されています。
原子は極微の大きさのもので、わずか1グラム原子(各元素の原子量に等しいグラム数)の中におよそ6x1023個の超天文学的な数の原子が存在していて、金属ではそれらが全部立体的に規則正しく並んでいます。その中の最も基本になる配列を基本単位格子とよんでおり、これは1個の原子のみを含む格子をいいます。立体的な対称性を考えに入れて2個以上の所属原子を含む格子を、単位格子または単位胞(unit cell)と呼びます。
下記が、3つの基本的な結晶構造の単位胞になります。
体心立方格子
体心立方格子(body-centered cubic lattice, 略してboc)の単位胞は、真四角の立方体の各隅と中心(体心)に原子が1個ずつ存在する配列です。
原子は、-273℃(すなわち絶対温度の0K)ではこの状態を保ってほとんど静止しているが、温度が高くなるにつれてこの位置を中心にして振動の振幅は次第に大きくなり、室温では原子は盛んに振動します。
体心立方格子は9個の原子から構成されていますが、隣り合った格子と併用して原子を共有しているため、実質1つの格子に含まれる原子の数は2個になります。
主に該当する金属
・鉄、クロム、ナトリウム、カリウム、リチウム、バナジウム
面心立方格子
面心立方格子(face-centered cubic lattice,略してfoc)の単位胞は、立方体の各隅と各面の中心(面心)にそれぞれ1個ずつ原子が存在する配列です。
面心立方格子は14個の原子から構成されていますが、隣り合った格子と併用して原子を共有しているため、実質1つの格子に含まれる原子の数は4個になります。
主に該当する金属
・アルミニウム、カルシウム、金、白金、銀、銅、鉛、ニッケル
金属の変態
同素変態
室温における鉄(Fe)(体心立方格子)と高温度に加熱した時の鉄(Fe)(面心立方格子)とでは、一見同じ性質のFeに見えても、その結晶構造すなわち原子の並び方はまったく異なっています。そのため性質も全く違ってきます。
このように一つの物質が原子配列を変化して性質の異なったものに変わることを変態(transformation)といい、その変化が起きる温度を変態点といいます。固体が融解して液体に変わるのも変態の1つです。
金属の場合には、このような固体から液体に変わる変態のほかに、鉄(Fe)の例にも見られるように、固体の中においても変態が起こります。
同一元素が原子の配列や結合の仕方が異なる単体に変わる場合、それらの単体を互いに同素体(allotropy)といいます。
酸素(O2)とオゾン(O3)や赤リンと白リンは同素体の一例で、この場合の変態を同素変態(allotropic transformation)といいます。
前述のFeの変態も同素変態で、体心立方格子のFeをα-Fe、面心立方格子のFeをγ-Feといいます。
A3変態
変態では原子の並び方が変わるので、同一元素であってもその変態点を境として種々の性質が変化します。
そのため、変態点を知るには加熱または冷却しながら適当な性質の変化を求める必要があり、鉄(Fe)の棒を加熱、冷却しながらその長さの変化を求める方法があります。
鉄(Fe)の棒を加熱していくと膨張していきますが、ある一定の温度で縮小していきます。これは、はじめ体心立方の結晶格子が過熱によって面心立方の結晶格子に変化したためで、前述したように、体心立方格子よりも面心立方格子の構造の方が原子がより密につまっているために起こる現象です。
鉄(Fe)のこの変態を A3変態 といいます。
冷却の場合にはまったく逆の変化が起きますが、変態では原子の並び方が変わるために加熱と冷却では変化が起きる温度に若干のずれが生じ、加熱ではやや高く冷却ではやや低く起こります。鉄(Fe)に種々の原子(主に炭素C)が合金されると、この加熱と冷却の変態点の開きは大きくなり、これを利用したのが焼入れと呼ばれる熱処理です。
Sponsored Link
関連図書